
請于接待時間致電,我們將竭誠為您提供優質的服務


疫苗作為目前唯一的預防性藥品,一直以來受到各界關注,全球疫苗市場在剛性需求下得以長期穩定增長。根據Evaluate Pharma數據顯示,2018年全球疫苗市場規模達到276.82億美元。多家藥企加入疫苗行業,市場規模有望進一步擴大。
在高門檻、高投入、高利潤、嚴監管的特點下,疫苗行業正處于寡頭壟斷的競爭格局,多年來全球疫苗銷量前十中約一半左右來自四大巨頭。我國疫苗產業發展在全球范圍內相對落后,提升空間相對突出。
加速推進新冠疫苗研發進程
2020年以來,全球多地的新冠疫情防控形勢嚴峻,部分地區持續惡化。截至12月16日9時,國內累計確診新冠肺炎病例數95279例,海外累計確診病例超過2054萬例、累計死亡病例數破163萬例,其中美國新冠肺炎病例總數超過1714萬例。根據世界衛生組織(WHO)的意見,全球約70%人口接種新冠病毒疫苗,也就是說全球或需百億劑新冠疫苗才能完全阻斷新冠疫情蔓延,結束本次大流行。
按照傳統經驗,研發疫苗需耗時數年,經歷臨床前研究、臨床I期/II期/III期試驗和上市幾個階段。新冠疫苗作為全球創新產品,研發呈現出前所未有的態勢。復星醫藥全球研發總裁兼首席醫學官回愛民博士在COVID-19疫苗/抗體研發與產業化論壇上透露,新冠疫苗有望將研發時間從傳統疫苗的十年縮短為一年。在快速審批和多方合作的特殊研發模式下,根據WHO統計數據,截至11月12日,全球已有48款新冠疫苗進入臨床研發階段,另有164款處于臨床前研發階段。數據顯示,全球目前共有13款新冠疫苗進入III期臨床試驗。
國外藥企爭分奪秒搶占新冠疫苗賽道,預計明年年初將迎來新冠疫苗密集上市潮。12月2日,輝瑞和拜恩泰科(BioNTech)的新冠疫苗BNT162b2獲得世界上第一個抗擊COVID-19的疫苗授權,在英國獲批緊急使用。此前他們的疫苗顯示出超過90%的保護效率。另一款由莫德納(Moderna)研發的新冠疫苗在第三期臨床試驗中的保護率達到94.5%,美國食品藥品監督管理局(FDA)已在12月15日發布的文件中認可該疫苗的安全性和有效性,有望繼輝瑞/ BioNTech的新冠疫苗之后,在本周內獲得FDA的緊急使用授權。除英國、俄羅斯和美國率先啟動接種工作外,法國、德國、羅馬尼亞等國也于近日公布了本國新冠疫苗接種計劃。
我國疫苗市場迎來新突破
國內疫苗企業正迎來快速實現技術升級的空前良機。10月8日,中國同全球疫苗免疫聯盟簽署協議,正式加入"新冠肺炎疫苗實施計劃"(COVAX)。該計劃預計于2021年底前提供20億劑新冠疫苗,旨在確保所有國家都能同時獲得新冠疫苗,并優先提供給衛生工作者和老年人等高風險人群。截至目前,我國已有5款新冠疫苗進入III期臨床試驗。
未來,中國疫苗作為全球公共產品,還將可能通過援助等方式來實現部分發展中國家或不發達國家新冠疫苗的可及性和可負擔性。
此外,受新冠肺炎疫情影響,大眾健康和接種意識大幅提升,我國今年秋季流感疫苗需求旺盛。根據莫尼塔數據顯示,截至8月20日,今年流感疫苗共計批簽發1415.56萬支,同比增長52%,但上海、天津、重慶、浙江、廣西等地均出現"一苗難求"的情況。
新政策規范疫苗市場
在《中華人民共和國疫苗管理法》(下稱《疫苗管理法》)頒布之前,我國擬定了多項監管政策,涉及研發、生產、審批、流通、監督檢查、異常反應處理6大環節,具體政策如下表所示。
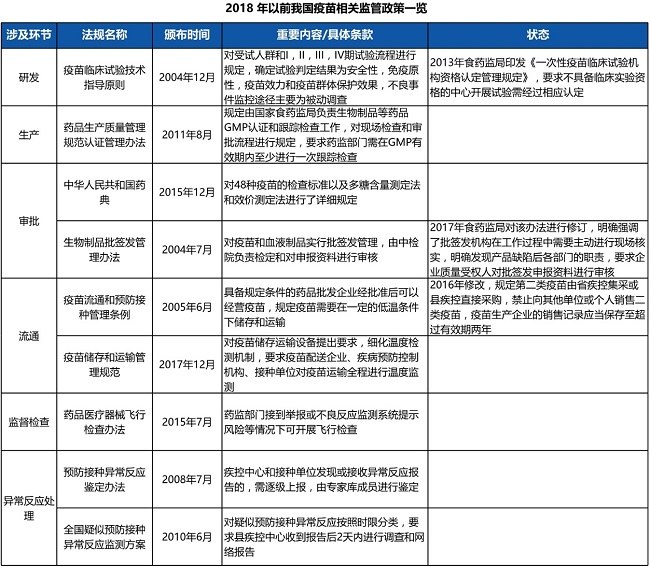
2019年12月1日,全球首部疫苗相關的法律--《疫苗管理法》正式施行。該法對于生產企業的規模、質控、技術工藝提出更高的要求,拓寬了疫苗企業在生產、銷售、流通領域的護城河,也明確規定當出現特別重大公共衛生事件,由國家衛生健康委提出緊急使用疫苗的申請,由國家藥監局組織專家論證并同意,由國家衛生健康委在一定范圍、一定時限內緊急使用疫苗。因此,受新冠疫情影響,目前我國正式開始緊急使用新冠疫苗,比如上海已對一線接觸進口貨物處理的員工提供免費自愿疫苗緊急接種。
此外,11月19日,國家藥品監督管理局藥品審評中心(CDE)官網發布了關于《藥品附條件批準上市技術指導原則(試行)》的通告,即時施行。根據該指導原則,藥物臨床試驗期間,符合兩種特定情形的藥品,可以申請附條件批準。該新政策的發布將有利于加速我國疫苗產品的上市。